peptidaaseja ovat entsyymejä, jotka hajottavat katalyyttisesti peptidien ja proteiinien peptidisidokset hydrolisaation avulla, ts. kiinnittymällä H2O-molekyyliin.
Peptidaasit toimivat ekstra- ja solunsisäisesti. Kyse ei ole pelkästään proteiinien ja peptidien hajottamisesta energiantuotantoa varten ja fragmenttien uuttamisesta uusien proteiinien rakentamiseksi, vaan myös joukosta erikoistuneita toimintoja, kuten entsymaattisesti vaikuttavien proteiinien tai välittäjäaineiden aktivointi.
Mikä on peptidaasi?
Tärkein ominaisuus, joka luonnehtii kaikkia peptidaaseja, on niiden kyky hajottaa peptidisidokset kahden aminohapon välillä hydrolyysin avulla. H20-molekyyli on talletettu ja vastaa käytännössä peptipti- prosessin käänteistä.
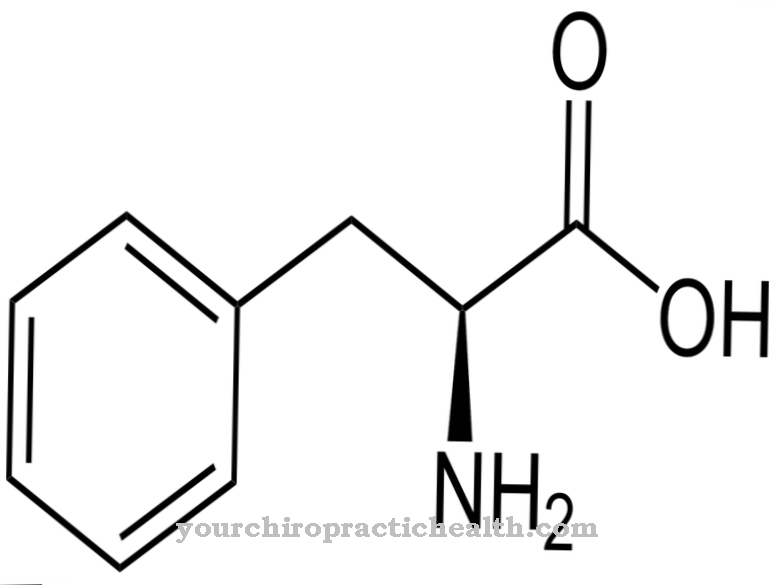
Proteiinit ja peptidit koostuvat aminohappojonosta peptidisidosten kautta. Ainoa ero peptidien ja proteiinien välillä on, että proteiinit koostuvat ketjuista, joissa on enemmän kuin noin 100 aminohappoa, kun taas peptideillä on lyhyemmät ketjut, vähintään kaksi - enintään 100 aminohappoa. Tietyille hyökkäys- ja katalyysiprosesseille erikoistuneiden peptidaasien lukumäärä asettaa haasteen yleiselle luokittelulle. Perus- ero voidaan tehdä ekso- ja endopeptidaasien välillä.
Exopeptidaasit hyökkäävät peptidiketjuihin joko N-terminaalisesta päästä (aminopeptidaasit) tai C-terminaalisesta päästä (karboksipeptidaasit) ja ovat erikoistuneet jakamaan yksi aminoryhmä kerrallaan tai kokonaiset peptidifragmentit kahdella, kolmella tai useammalla aminohapolla. Endopeptidaasit ovat erikoistuneet hyökkäämään tiettyihin pisteisiin proteiineihin.Usein tämä on entsyymin aktivointiprosessi, verrattavissa lukitusvivun poistamiseen. Peptidaasit voidaan luokitella kansainvälisen EY-nimikkeistön mukaan.
Toiminto, vaikutukset ja tehtävät
Peptidaasit suorittavat useita erilaisia perustoimintoja. Aineenvaihdunnan katabolisessa haarassa näkyvin toiminta ja tehtävä on proteiinien pirstoutuminen ruoassa voidakseen absorboida niitä suolen limakalvon läpi.
Proteiinien sirpalointitoimintoa tarvitaan kehossa myös kehon omien proteiinien hajottamiseksi energian tuottamiseksi tai proteiinifragmenttien tuottamiseksi aineenvaihdunnan anaboliseen osaan uusien proteiinien muodostamiseksi. Toinen tehtävä ja tehtävä on aktivoida tietyt proteiinit synteesin jälkeen jakamalla tietty aminohappo. Ns. Signaalipeptidit irrottavat signaalipeptidit proteiineista. Tämä varmistaa, että solunsisäisesti tuotetut proteiinit kuljetetaan aiottuun käyttöpaikkaansa. Tärkeä peptidaasien tehtävä on heidän osallistuminen antigeenien synteesiin.
Tämän funktion suorittamiseksi peptidaasit yhdistyvät peptidaasikompleksin, proteasomin, muodostamiseksi. Solunsisäisiä peptidaaseja löytyy melkein kaikista soluosastoista ja soluorganelleista, joissa muun muassa ne ylläpitävät proteiinitasapainoa. Peptidaasit hoitavat myös tärkeitä toimintoja hyytymisprosessissa ja ovat sen vuoksi yhdessä vastuussa haavan nopeasta sulkeutumisesta muodostamatta verihyytymiä, jotka voivat kulkeutua verenkierron mukana ja johtaa sydänkohtauksiin.
Koulutus, esiintyminen, ominaisuudet ja optimaaliset arvot
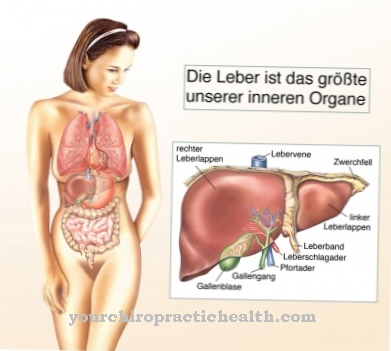
Peptidaaseja esiintyy melkein kaikissa kudoksissa solunulkoisina peptidaaseina ja käytännöllisesti katsoen kaikissa soluissa solunsisäisinä peptideinä, jokaisella on eri tehtävät, mutta samanlaiset toiminnot ja vaikutukset. Solunulkoiset peptidaasit erittävät eksokriinisten rauhasten, kuten suun sylkirauhasten, mahalaukun limakalvon ja ennen kaikkea haiman kautta.
Proteiinien hajoamisprosessi alkaa suusta ja jatkuu vatsassa. Proteiinien lopullinen jakautuminen määriteltyihin kappaleisiin, jotka suoliston limakalvon endoteelisolut voivat ottaa vastaan ja resorboida, tapahtuu pääasiassa pohjukaiskaisessa, ohutsuolen ensimmäisessä osassa mahalaukun jälkeen. Ohutsuolessa peptidaasit aktivoivat ruuansulatusentsyymien alustavat vaiheet, joita kutsutaan tsymogeeneiksi, bioaktiivisessa muodossa jakamalla tietyt aminohapot. Viitearvojen määrittäminen tai peptidaasien optimaaliset pitoisuudet voivat koskaan liittyä vain tiettyyn peptidaasiin, ja parhaimmillaan se mahdollistaa johtopäätösten tekemisen tiettyjen ongelmien olemassaolosta vain vertaamalla niitä muihin laboratorioparametreihin ja myöhemmin erotusdiagnoosiin.
Esimerkiksi kohonneella leusiini-aminopeptidaasitasolla (LAP) ei voida vielä päätellä, että kolestaasia, ruoansulatusentsyymien kertymistä esiintyy. Naisten LAP-arvot ovat 16-32 yksikköä litralta ja miesten 11-35 yksikköä litralta. Jos pitoisuudet ovat liian korkeat, ne tulisi tarkistaa tiettyjen veren maksaentsyymien, kuten alkalisen fosfataasin, gamma-GTP: n, ja joidenkin muiden arvojen perusteella.
Sairaudet ja häiriöt
Entsyymit edustavat proteiinien suurinta aineryhmää, peptidaaseilla ja lipaaseilla on tärkeä tehtävä ruuansulatuksessa.
Suuri määrä peptidaaseja - yli 250 erilaista peptidaasia tunnetaan - tarkoittaa, että myös aineenvaihduntahäiriöitä, jotka on hankittu, ts. Johtuvat epätasapainoisesta ruokavaliosta, sairaudesta tai toksiineista, voi myös esiintyä. Toisaalta voidaan olettaa, että myös geenimutaatiot voivat vaikuttaa ja heikentää entsyymimetabolian monimutkaista vuorovaikutusta. Aineenvaihduntahäiriöistä johtuvat oireet ja riskit voivat vaihdella lievistä vaikeisiin.
Vasta äskettäin on tutkittu yhteyksiä epäspesifisten oireiden ja spesifisten häiriöiden välillä peptidaasien ja muiden entsyymien metaboliassa. Pienentynyt peptidaasiaktiivisuus suolistossa johtaa suurempien ketjujen peptidien imeytymiseen, jotka esiintyvät proteiinifragmentteina veressä, ja lisääntyneeseen erittymiseen munuaisten kautta, jotta tosiasiat voidaan määrittää suhteellisen helposti virtsa-analyysillä. Mielenkiintoista, vähentynyt peptidaasiaktiivisuus on liitetty sairauksiin, kuten ADD, ADHD, skitsofrenia, autismi ja masennus.





.jpg)
.jpg)